理化性质
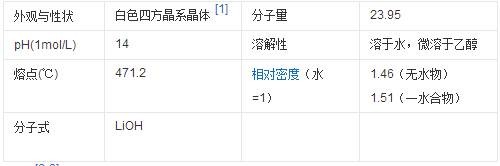
物理性质
化学性质
很容易在空气中吸收二氧化碳和水分,但吸收能力较NaOH,KOH稍差。氢氧化锂具有碱的通性,可发生如下反应。
1.碱性反应
可使紫色石蕊试液变蓝,使无色酚酞变红;而其浓溶液经实验验证,可以使酚酞变性,使溶液由红色变为无色(类似于浓NaOH)。
2.与酸中和
HCl+LiOH=LiCl+H2O
3.与酸性氧化物反应
2LiOH+CO2=Li2CO3+H2O(该反应在航天中用于吸收二氧化碳)
4.与金属盐溶液反应
FeCl3+3LiOH=Fe(OH)3↓+3LiCl[4]
用途
氢氧化锂可用做光谱分析的展开剂、润滑油。碱性蓄电池电解质的添加剂,可增加电容量12%~15%,提高使用寿命2~3倍。
可用做二氧化碳的吸收剂,可净化潜艇内的空气。
化学方程式为:2LiOH(s)+CO2(g)=Li2CO3(s)+H2O(l)。
用于制锂盐及锂基润滑脂,碱性蓄电池的电解液,溴化锂制冷机吸收液等;石油、化工、轻工、核工业等用。用于碱性蓄电池时,铝含量不大于0.06%,铅含量不大于0.01%。用作分析试剂、照相显影剂,也用于锂的制造;要用作制取锂化合物的原料。也可用于冶金、石油、玻璃、陶瓷等工业。
制备
复分解法
氢氧化锂通常是靠将碳酸锂与石灰乳调成浆状,用100℃水蒸气加热,滤去碳酸钙的方法来制备。该法比较常用。Li2CO3(s)+Ca(OH)2=2LiOH(s)+CaCO3↓
氧化还原法
金属锂与水作用制取。该法原料较为昂贵,比较少用。[7]
Li+H20=LiOH+H2
注意事项
危险性概述
健康危害:该品腐蚀性极强,能灼伤眼睛、皮肤和上呼吸道,口服腐蚀消化道,可引起死亡。吸入,可引起喉、支气管炎症、痉挛,化学性肺炎、肺水肿等。
环境危害:对环境可能有危害,对水体可造成污染。
燃爆危险:该品不燃,具强腐蚀性,可致人体灼伤。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:用水漱口,给饮牛奶或蛋清。就医。
消防措施
危险特性:腐蚀性极强。与酸发生中和反应并放热。在水中形成腐蚀性溶液。
有害燃烧产物:可能产生有害的毒性烟雾。
灭火方法:消防人员必须穿全身耐酸碱消防服。灭火时尽可能将容器从火场移至空旷处。然后根据着火原因选择适当灭火剂灭火。
泄漏应急处理
应急处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿防腐防毒服。不要直接接触泄漏物。
小量泄漏:小心扫起,转移至安全场所。
大量泄漏:收集回收或运至废物处理场所处置。
操作注意事项:密闭操作,提供充分的局部排风。防止粉尘释放到车间空气中。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴防尘面具(全面罩),穿橡胶耐酸碱服,戴橡胶耐酸碱手套。避免产生粉尘。避免与氧化剂、酸类、二氧化碳接触。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存方法
储存注意事项:储存于干燥清洁的仓间内。远离火种、热源。防止阳光直射。包装密封。应与氧化剂、酸类、二氧化碳、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
安全风险
安全术语
切勿吸入粉尘。
不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
穿戴适当的防护服、手套和护目镜或面具。
若发生事故或感不适,立即就医(可能的话,出示其标签)。[3]
风险术语
吸入及吞食有害。
引起严重灼伤。
对水生生物有害,可能对水体环境产生长期不良影响。
内容来自百科网

